南京爱贝生物的小鼠体外受精操作步骤及操作视频
下述操作有视频资料,仅供参考
链接:https://pan.baidu.com/s/1XCcKQ2J81pGZS0a3Daf2vg试剂耗材准备
| 1 | PMSG | 10 | 200 μL移液器 |
| 2 | hCG | 11 | 灭菌眼科剪2把 |
| 3 | 1mL 注射器 | 12 | 灭菌眼科镊2把 |
| 4 | M2培养液 | 13 | 体视显微镜 |
| 5 | TYH培养液 | 14 | 倒置显微镜 |
| 6 | HTF培养液 | 15 | 二氧化碳培养箱(37℃, 5% CO2, 95% air) |
| 7 | KSOM培养液 | 16 | 胚胎转移用口吸管 |
| 8 | 矿物油 | 17 | 1 .5 mm毛细玻璃管 |
| 9 | 独立包装一次性塑料巴氏吸管 | 18 | 35 mm胚胎培养皿 |
1.超数排卵
小鼠腹腔注射方法
抓住小鼠颈部靠近耳朵处的皮肤,以防止其转头,并将尾巴缠绕于小手指固定。使用1 mL注射器以 45°角斜向刺入腹腔,注意不要刺伤膈肌及其他器官。轻轻回抽,确认无血液回流后注射液体。稍等片刻后再拔针,以防液体渗漏。操作时请佩戴防咬手套;如被咬伤,应立即就医处理。

图1-1 腹腔注射示意图
2.培养皿准备
注射hCG当日准备下述培养皿过夜平衡。每制备2个皿应立即加入矿物油覆盖微滴,避免培养液中的水分蒸发,影响渗透压。培养皿盖应注明实验名称缩写(皿盖侧面也需标注),日期及培养液名。当一个实验的皿超过2个,应在皿盖上注明XX1、XX2等表明顺序。培养皿底部应依次标注胚胎序号。
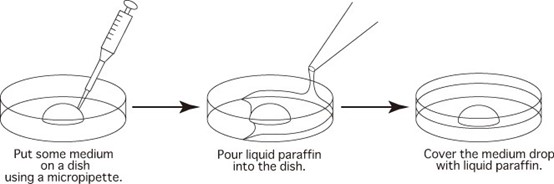
图2-1 培养皿制作示意图
3.精子获能
●取卵当日先杀雄鼠取附睾尾部精子获能。快速颈椎脱臼法处死雄性小鼠(图3-1):把小鼠放在鼠笼上面,使它前爪抓住笼子上面的钢丝条,紧紧压住它的颈部,同时水平向后拉伸尾部,使其断颈。

图3-1 快速颈椎脱臼法处死小鼠示意图
●成年小鼠的睾丸大约有一粒黄豆大,在睾丸下方一点与睾丸相连的位置,能看到白色附睾,其表面可见曲精小管结构(图3-2)。
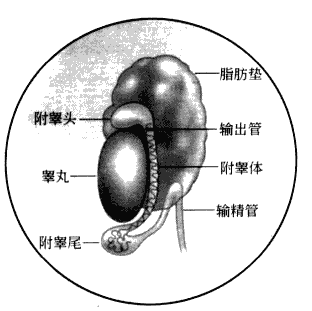
图3-2 雄鼠睾丸结构示意图
●找到附睾后,迅速用眼科剪和眼科镊将附睾及输精管剪下置于精子获能滴中,用注射器针头将附睾尾划破,待精子溢出后,培养箱孵育10 min,取出体视镜下观察,精子扩散后,放入培养箱继续孵育50 min后可用。
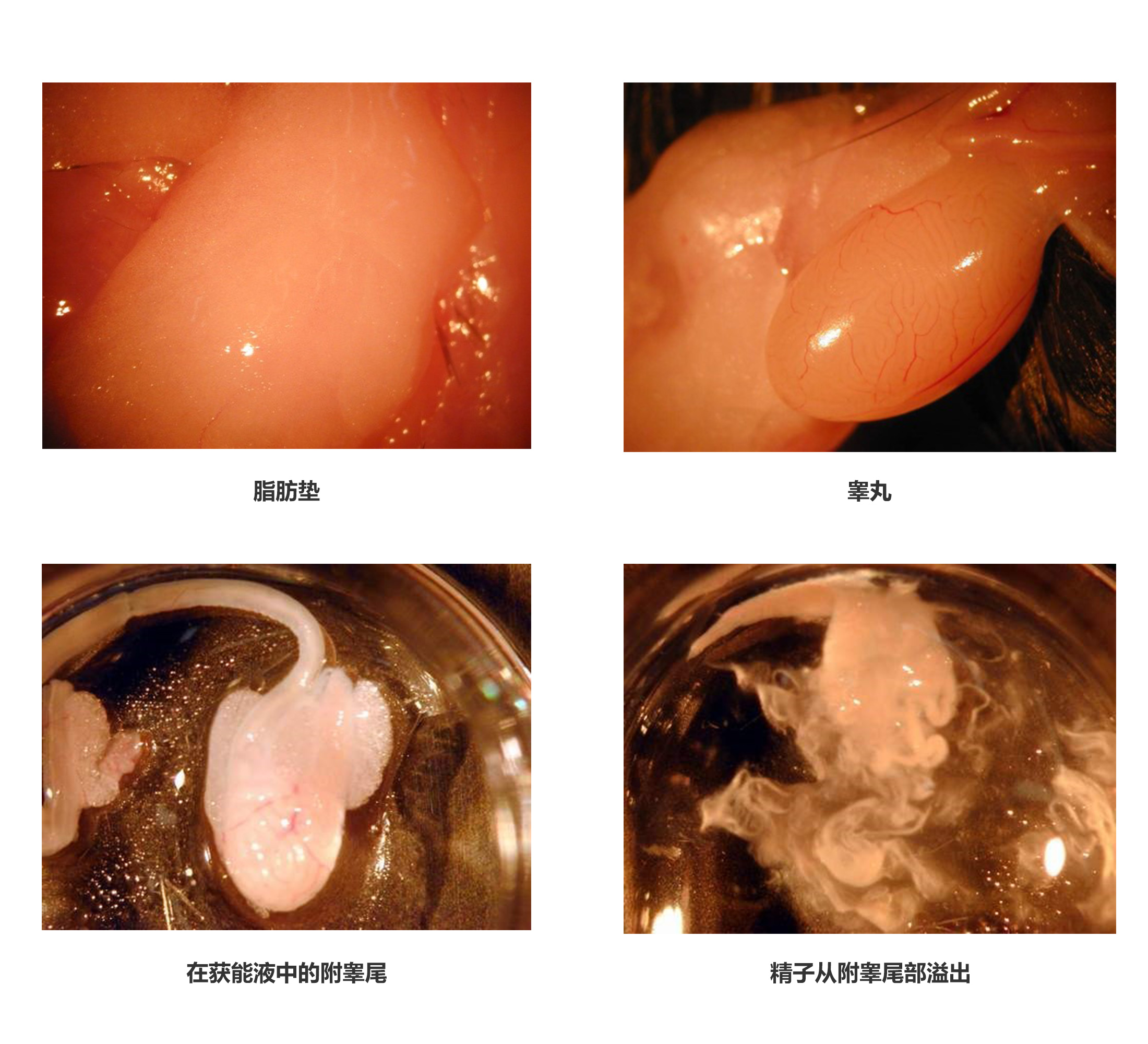
图3-3 附睾尾精子释放示意图
4.取卵
●精子获能后,将M2培养液铺满整个皿底,矿物油覆盖,置于37℃加热平板上加热30 min。M2培养液含有HEPES,可以在二氧化碳培养箱外维持pH值稳定,因此只需要加温即可。
●精子获能50 min后,快速颈椎脱臼法处死雌性供体小鼠。
●将小鼠放在纸上,用75%的乙醇消毒腹部。
●用第一套眼科镊捏住皮肤并用眼科剪在皮肤上做一小切口。然后用力将皮肤拉到头部,完全暴露腹部。然后用第二套器械剪开腹膜,完全暴露内脏器官。将肠管拉向一侧后即可在腹腔中见到两侧的子宫和相连的卵巢。卷曲的输卵管在卵巢和子宫之间(图4-1)。(注意不能用剪开皮肤的眼科剪和眼科镊去剪腹膜和输卵管,防止出现污染)。
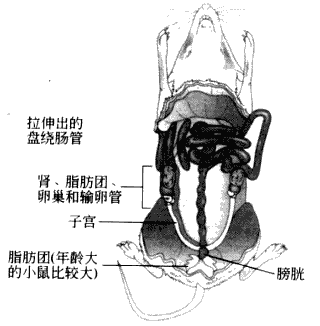
图4-1 小鼠腹腔解剖示意图
●用眼科镊夹住子宫将其提起,这有利于将子宫和腹膜分离开。用眼科剪在膜上刺破一小口,然后将子宫分离下来。仍用镊子夹住子宫,用显微剪在卵巢和输卵管之间剪开。切口必须尽可能的接近输卵管。将镊子移到输卵管处夹住输卵管,在输卵管和子宫之间在剪一刀(图4-2)。
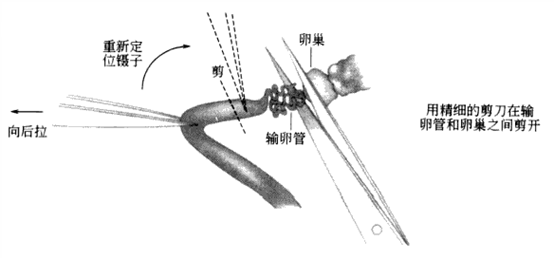
图4-2 输卵管分离示意图
●将输卵管放入M2捡卵滴中。将有输卵管的皿移至体视镜下,用两个1 mL注射器针头配合切开输卵管壶腹部,释放COC(图4-3)。

图4-3 壶腹部释放COCs示意图
5.授精
●用口吸管和灭菌1.5 mm毛细玻璃管将COCs转移到HTF清洗皿内,反复吹打,尽量洗去HEPES。
●转移至HTF受精皿内,每个滴放2团COCs。
●用移液枪从精子获能皿中吸取6 μL精子加入授精滴内。精子密度1-5×10^6为宜(以放入培养箱中10 min后能看到COC被精子打散,精子能推动COC运动即可)。
●整个受精过程以5 min内完成为宜(杀鼠到受精入箱)。

图5-1 加精示意图
●受精6 h后,用1.5 mm毛细玻璃管拉制的直径100 μm吸管将受精卵从受精滴中移入KSOM培养皿液滴中,反复吹打,直至透明带上基本无精子残留,移到一个新滴中继续培养4 h,观察原核形成情况,以形成原核和排出PB2为受精标志,计算受精率。
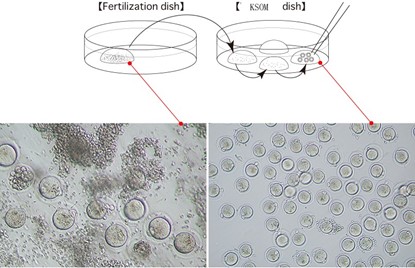
图5-2 受精卵转移与清洗示意图